Hello,大家好,今天我们来学习常见的碱,本节内容我们将学习:
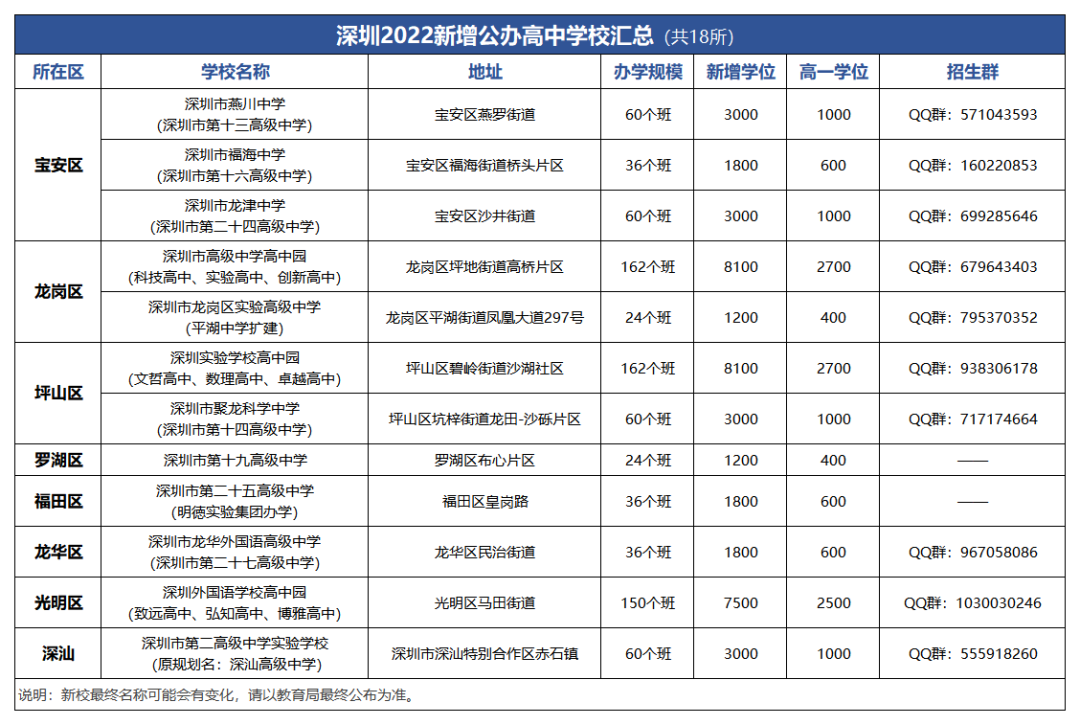
1. 碱和碱性的盐,它们的俗名和用途
2. 初中常见的碱,烧碱、熟石灰和氨水的物理性质,氢氧化钠和生石灰的干燥原理,碱的溶解性
3. 氢氧化钠和氢氧化钙的化学性质
4. 复分解反应和中和反应的定义,复分解反应的条件
5. 氢氧化钠的变质专题知识点
一. 初中阶段接触到的碱和碱性物质
1. 碱
(1)氨水:氨水是氨的水溶液,有强烈刺鼻气味,具有弱碱性,溶质的化学式是NH3.H2O。
(2)氢氧化钙:俗称熟石灰或消石灰,常用于建筑业、改良酸性土壤和配制波尔多液,澄清的石灰水可以用来检验二氧化碳气体。
波尔多液是硫酸铜和熟石灰按不同比例配制成的蓝色胶状悬浊液,用作杀真菌剂。配制波尔多液的化学反应方程式是:Ca(OH)2 + CuSO4 = CaSO4 + Cu(OH)2↓
(3)氢氧化钠:俗称烧碱、火碱、苛性钠。可用于制人工丝、造纸、炼油、纺织、印染与橡胶工业。
2. 碱性的盐
(1)碳酸钠:俗称纯碱或苏打;
(2)碳酸氢钠:俗称小苏打;
(3)碳酸钾:草木灰的主要成分。
二. 烧碱、熟石灰和氨水的物理性质
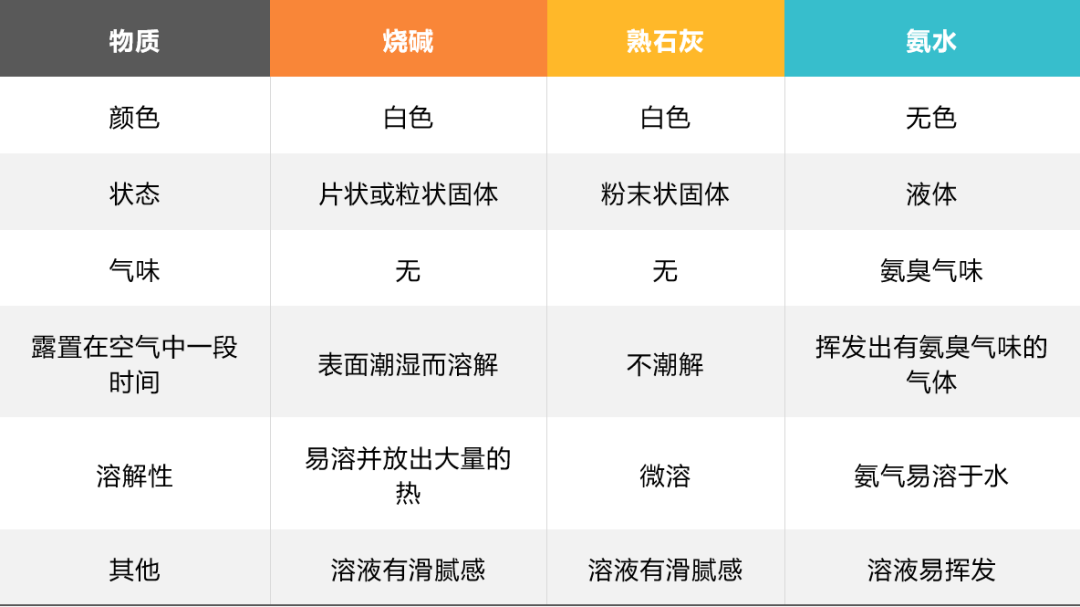
补充:
氢氧化钠的潮解过程是物理变化。利用氢氧化钠的这一性质可以干燥氨气,NaOH固体能与CO2、SO2、HCl等气体发生反应,所以NaOH固体不能干燥这三种酸性气体;
生石灰具有强烈的吸水性,极易跟水反应。人们利用这一性质,常用生石灰做干燥剂;
NaOH易潮解且和CO2反应,Ca(OH)2也可以和CO2反应,所以保存的时候需要密封保存。
碱的溶解性
可溶性碱:KOH、NaOH、Ba(OH)2
微溶:Ca(OH)2
溶挥:氨水
不溶:Mg(OH)2、Al(OH)3、Zn(OH)2、Fe(OH)2、Fe(OH)3、Cu(OH)2
三. 氢氧化钠和氢氧化钙的化学性质
1. 与指示剂反应使指示剂变色
可溶性碱NaOH和Ca(OH)2可以使紫色石蕊试液变蓝色,使无色酚酞变红色。
难溶性碱不能使指示剂变色,比如Cu(OH)2,Fe(OH)3,Mg(OH)2
2. 与非金属氧化物反应
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + SO2 = Na2SO3 + H2O
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Ca(OH)2 + SO2 = CaSO3↓ + H2O
3. 与盐反应(复分解反应)
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓(氢氧化铜是蓝色沉淀)
2NaOH + FeCl3 = Fe(OH)3 + 3NaCl(氢氧化铁是红褐色沉淀)
Ca(OH)2 + CuSO4 = CaSO4 + Cu(OH)2↓(制农药波尔多液)
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH(工业制烧碱)
4. 碱和酸能发生中和反应生成盐和水(复分解反应)
NaOH + HCl = NaCl + H2O
Ca(OH)2 + 2HCl = CaCl2 + H2O
5. 腐蚀性
氢氧化钠溶液对皮肤、纸张、织物有腐蚀性,石灰水也有腐蚀性。
四. 复分解反应和中和反应
1. 复分解反应:两种化合物相互交换成分,生成两种新的化合物,这类反应称为复分解反应。复分解反应的条件是有气体、沉淀或水生成。
2. 中和反应:酸和碱作用生成盐和水的反应称为中和反应。中和反应也属于复分解反应。
五. 氢氧化钠的变质专题
1. 定义:NaOH变质,是指NaOH固体和空气中的CO2发生反应生成了Na2CO3和H2O。我们只要想办法判断NaOH固体固体中是否有碳酸根,就可以确定NaOH是否变质。
2. 常见的考试题型
确定样品是否变质,此时只要其额定样品中是否含有碳酸根就可以了;
研究氢氧化钠样品的变质情况,或者说变质程度,此时需要确定样品中是否含有碳酸根和氢氧根。
3. NaOH的变质机理
2NaOH + CO2 = Na2CO3 + H2O
2*40 106
通过这个化学方程式,可以得出结论:氢氧化钠和二氧化碳反应生成碳酸钠,引入了碳酸根,且固体样品的质量变大了。
4. 验证NaOH是否变质的实验操作:一共有3种操作方法。
(1)取少量样品于试管中,滴加HCl(或H2SO4),如果有气体产生,说明变质。
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
(2)取少量样品于试管中,滴加Ca(OH)2或Ba(OH)2溶液,产生白色沉淀,说明已经变质;
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
Na2CO3 + Ba(OH)2 = BaCO3↓ + 2NaOH
(3)取少量样品于试管中,滴加CaCl2或BaCl2溶液,如果产生白色沉淀,说明已经变质。
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
4. 验证NaOH变质情况或程度的实验操作,NaOH的变质情况一共有3种,分别是:
完全变质:Na2CO3
部分变质:Na2CO3、NaOH
没有变质:NaOH
在验证氢氧化钠的变质情况时,我们应该注意既不能引入氢氧根也不能将氢氧根消灭。即:
不能加入酸:酸和碱会发生中和反应,消灭氢氧根;
不能加入碱:加入碱会引入氢氧根,使我们无法判断原样品中是否含有氢氧根。
具体的实验操作是:
(1)取固体样品,加入足量的水,使其溶解;
(2)在溶液中加入过量的CaCl2或BaCl2溶液,如果样品中有Na2CO3,会产生白色沉淀。
加入过量的CaCl2或BaCl2溶液的目的是为了确保Na2CO3全部沉淀,以排除对后面实验的影响。
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
(3)过滤、将溶液中的沉淀除去;
(4)在滤液中滴加酚酞、溶液变红,说明原样品中有氢氧化钠;或者在滤液中滴加氯化铜,有蓝色沉淀生成,说明样品中有氢氧化钠。
2NaOH + CuCl2 = 2NaCl + Cu(OH)2↓