初中化学、物质的除杂鉴别知识清单
一
除杂原则
1.不增:不引入新的杂质。
2.不减:提纯或分离的物质不能转变成其他物质,不减少被提纯的物质。
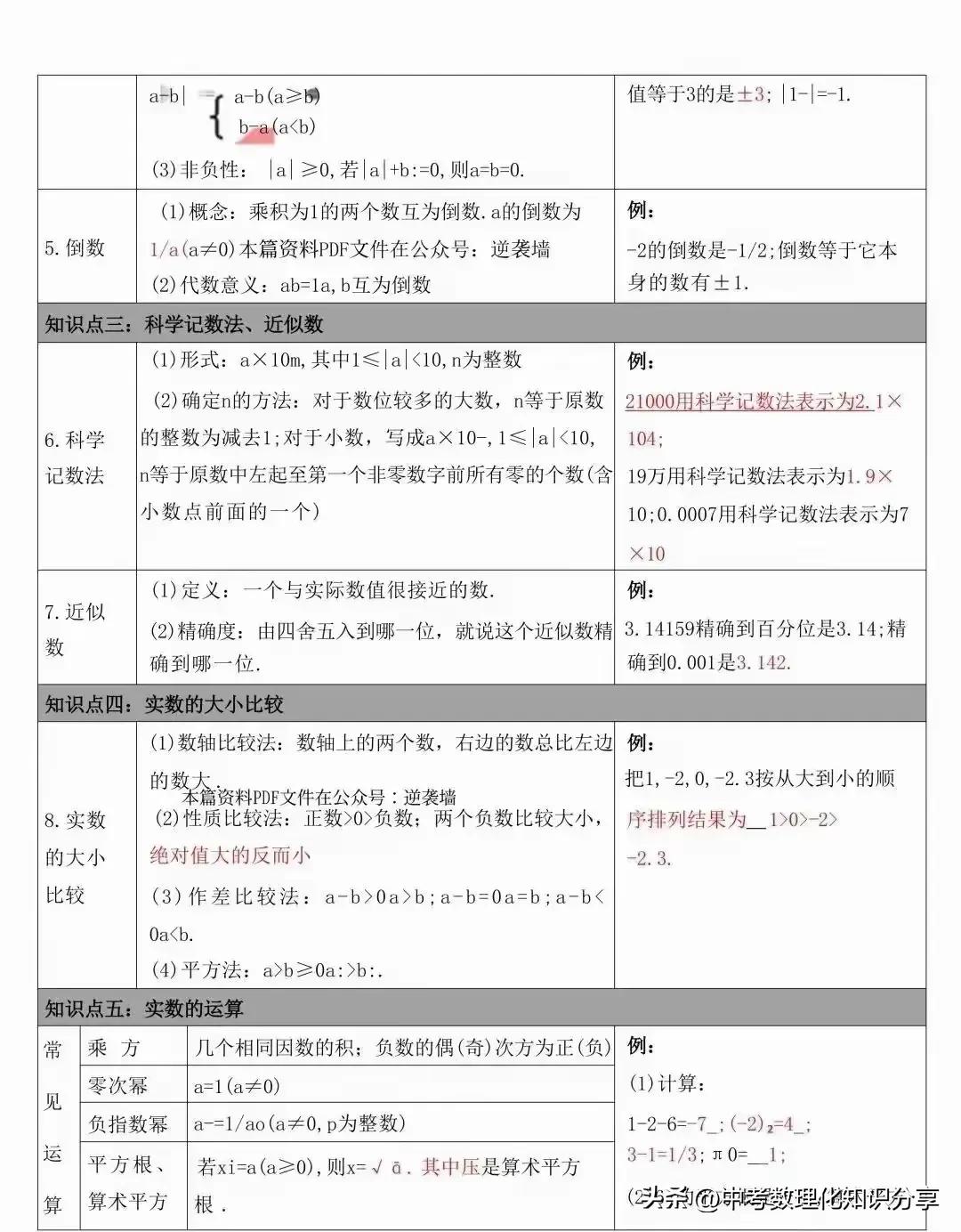
3.易分:杂质易分离。
4.复原:被保留的物质应能恢复原状。
二
除杂方法
1.物理方法
(1)过滤:适用于固体与液体混合物的分离,可溶性固体与不溶性固体混合物的分离。如:粗盐提纯。
(2)结晶:
①蒸发:适用分离溶质与溶剂,除去可挥发的杂质,从含有HCl的NaCl 溶液中分离出固体NaCl。
②降温:可溶性固体溶质的溶解度受温度影响大小不同,从含NaCl杂质的KNO3中提纯KNO3。
2.化学方法
(1)转化法:将固、液、气体中的杂质转化为被提纯物质。
(2)沉淀法:将杂质转变为沉淀而除去。
(3)气化法:将固、液体中的杂质转变为气体而除去。
(4)加热法:杂质受热易分解,通过加热将杂质除去。
(5)溶解法:将固体中的杂质转变为可溶物而除去。
(6)置换法:类似于转化法,选用合适的试剂将杂质置换出来而除去。
3.除杂示例
(1)除去CuO中的C:在氧气流中灼烧。
(2)除去CO中的CO2:使混合气体通过氢氧化钠溶液
2NaOH+CO2=Na2CO3+H2O
(3)除去CO2中的CO:使混合气体通过灼热的氧化铜。
(4)除去CaO中的CaCO3:高温煅烧。【注意】不能加稀盐酸, 因为CaO能与稀盐酸中的水反应生成Ca(OH)2。
(5)除去Cu中少量的Fe:物理方法——用磁铁反复吸引。化学方法——滴加稀盐酸或稀硫酸,然后过滤。【注意】不能加硫酸铜溶液,否则容易导致除杂不彻底。
(6)除去FeSO4溶液中的CuSO4:① 加入铁粉(铁丝);② 过滤。
总结:
(1)除去可溶物中的不溶物:① 溶解;② 过滤;③ 蒸发结晶。
(2)除去不溶物中的可溶物:① 溶解;② 过滤。
(3)将两种可溶物分离:见“溶液”单元的冷却热饱和溶液法和蒸发溶剂结晶法。
广告
(4)在溶液中,杂质有盐的时候,可以考虑把盐变成水、气体、沉淀。