一. 盐的性质
1. 盐的定义:组成里含有金属离子(或铵根离子)和酸根离子的物质。
2. 盐的分类
(1)按照阳离子,盐可以分为:钾盐,钠盐,铵盐,铁盐和铜盐等;
(2)按照阴离子,盐可以分为:氯盐,硫酸盐,硝酸盐和碳酸盐等;
(3)按照溶解性,盐可以分为:可溶性盐和难溶性盐。
3. 盐的溶解性
(1)钾盐、钠盐、硝酸盐在水中都是可溶解的;
(2)氯盐中除了氯化银难溶于水外,多数都是可溶的;
(3)硫酸盐中除了硫酸钡难溶于水,硫酸钙、硫酸银微溶于水外,其余多数都是可溶的;
(4)碳酸盐中除碳酸钾、碳酸钠、碳酸铵可溶,碳酸镁微溶外,其余都难溶。

4. 盐的化学性质
熟练的掌握盐的化学性质,可以帮助我们快速准确的解答推断题,盐可以和金属发生置换反应,某些盐还可以和酸、碱和盐发生复分解反应,复分解反应的条件是有沉淀、气体或者水生成。下面我们就看一下盐都可以发生哪些化学反应:
(1)某些金属可以和金属活动性没有它强的盐的溶液反应,生成新的盐和新的金属,这是一个置换反应,反应中的盐要可溶,否则不能反应。
金属 + 盐 → 新金属 + 新盐(置换反应)
例子:
Fe + CuCl2 = FeCl2 + Cu
K、Ca、Na等活泼金属不能置换盐溶液中的金属。因为这些金属性质活泼,会先与溶液中的水反应。在金属的盐溶液中,金属离子的数量比水分子的数量少很多,所以当K、Ca、Na等活泼金属倒入到溶液中时,一定先和溶液中的水分子反应。
(2)某些盐能够和酸反应,生成新的盐和新的酸,参与反应的盐可以是可溶的,也可以是难溶的,但反应中必须有气体或者沉淀或者水生成。
盐 + 酸 → 新盐 + 新酸(复分解反应)
例子:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
AgNO3 + HCl = AgCl↓ + HNO3
(3)某些盐可以与碱反应,生成新盐和新碱,反应物的盐和碱必须是可溶的,如果有一种不溶,就不能发生反应,生成物中必须有气体或沉淀。
盐 + 碱 → 新盐 + 新碱(复分解反应)
例子:
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 (用于检验碱性溶液)
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH(工业上制取烧碱)
(4)某些盐能与某些盐反应,生成两种新盐,反应物中的两种盐必须都可溶,若有一种不溶,该反应就不能够发生,生成物必须有沉淀。
盐1 + 盐2 → 新盐1 + 新盐2(复分解反应)
例子:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl(用于检验氢氧化钠是否变质)
NaCl + AgNO3 = NaNO3↓ + AgCl (用于检验氯离子或阴离子)
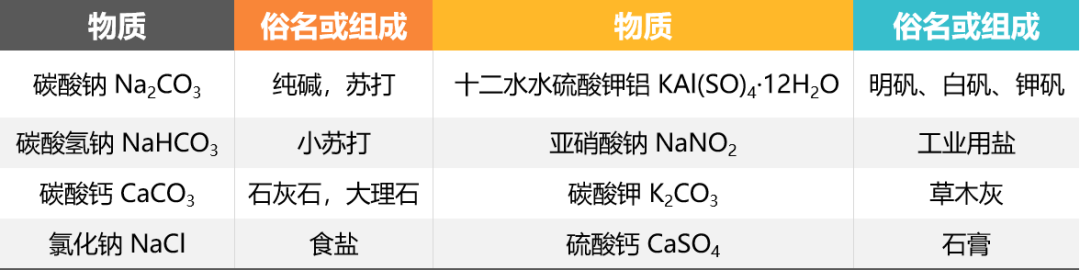
氯化钠
(1)氯化钠的性质
氯化钠是一种白色固体、易溶于水、溶解度随着温度升高变化不大,水溶液显示中性。
(2)氯化钠的工业制法
海水晒盐,粗盐提纯。
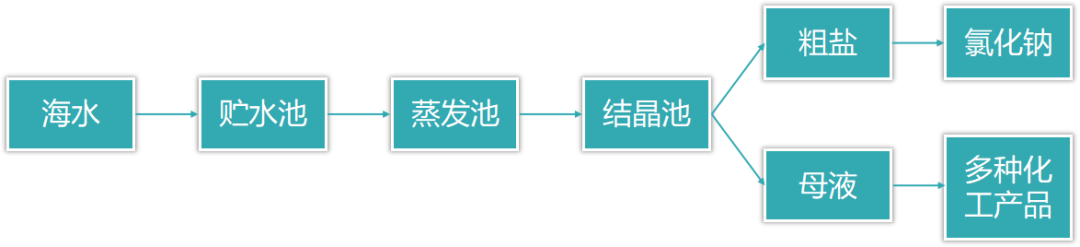
(3)氯化钠的用途
A. 医疗与健康
医疗上的生理盐水使用氯化钠配制而成的(生理盐水:100mL生理盐水中含有0.9g医用氯化钠)。
钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;氯离子是胃酸中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
人们每天都要摄入一些食盐来补充由于出汗、排尿等而排出的氯化钠,以满足人体的正常需要(每人每天约需3~5g食盐)。但长期使用过多食盐不利于人体健康。
B. 农业
农业上可以用氯化钠溶液选种。
C. 工业
工业上可以使用氯化钠为原料制取碳酸钠、氢氧化钠、氯气和盐酸等。
D. 生活
用食盐可以盐渍蔬菜、肉、蛋等,腌制成的食品不仅风格独特,还可延长保存时间(食物变质的原因是食物中产生了微生物,用盐腌制破坏了食物中微生物的生长与繁殖的环境,因此,能够减缓食物腐败变质的速度)。
公路上的积雪可以用氯化钠来消除(氯化钠溶于雪后形成的混合物,凝固点降低到-10℃,因此可以融雪,海水的凝固点低于0℃,也是因为其中含有氯化钠等盐等物质)。
(4)氯化钠的参加的化学反应
NaCl + AgNO3 = NaNO3↓ + AgCl
(5)知识点补充——氯离子和硫酸根离子的检验
氯离子的检验
阴离子和氯离子可以反应生成不溶于稀硝酸的AgCl白色沉淀,所以可以将溶液滴加到硝酸酸化的AgNO3溶液,有白色沉淀生成,证明溶液中含有Cl-。
NaCl + AgNO3 = AgCl↓ + NaNO3
硫酸根离子的检验
钡离子和硫酸根离子可以反应生成不溶于稀硝酸的BaSO4白色沉淀,所以可以将溶液滴加到硝酸酸化的 BaSO4 溶液,有白色沉淀生成,证明溶液中含有硫酸根离子。
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
银盐中Ag2SO4,Ag2CO3也不溶于水,钡盐中BaCO3也不溶于水,但是只有AgCl和BaSO4沉淀不溶于稀硝酸,所以一定要用硝酸酸化的AgNO3和Ba(NO3)2检验溶液中是否含有氯离子和硫酸根离子。