一、铁及其化合物
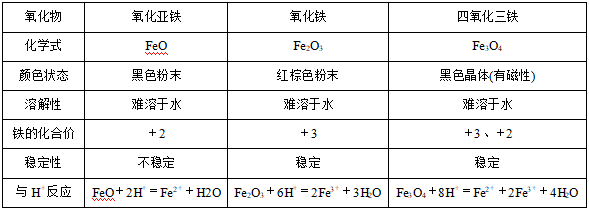
1、氧化物
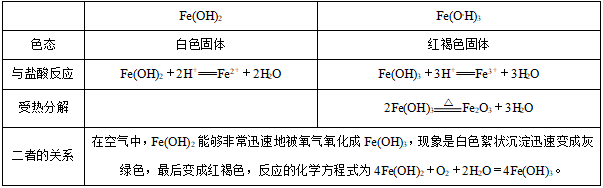
2、氢氧化物
注意:
Fe(OH)3作为一种碱能与酸反应生成盐和水,但Fe3+有较强的氧化性,若酸为还原性酸(如H2S、HI)则再发生氧化还原反应,故与HCl反应只是中和反应,而与HI反应的化学方程式如下:2Fe(OH)3+6HI=2FeI2+I2+6H2O。
②除杂方法(括号内为杂质):Fe2+(Fe3+):加过量铁粉过滤;FeCl3(FeCl2):加氯水或H2O2;FeCl2(CuCl2):加过量铁粉过滤;Fe(Al)、Fe2O3(Al2O3、SiO2):加过量强碱溶液过滤;
(2)盐溶液的保存:亚铁盐、铁盐的存放方法:亚铁盐溶液——加入少量铁屑以防止Fe2+被氧化。铁盐溶液——加入少量相应的酸溶液以防止Fe3+水解
(3)物质制备:
①制备无水氯化铁:在HCl气流中加热浓缩氯化铁溶液;
②制备氢氧化铁胶体:向沸水中加入饱和氯化铁溶液并煮沸至变为红褐色为止。
4、Fe2+和Fe3+检验:
(1)直接观察颜色:Fe2+溶液呈浅绿色,Fe3+溶液呈棕黄色。
(2)利用显色反应(形成络离子)
①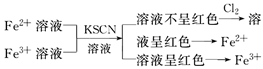
②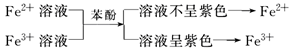
(3)利用Fe(OH)3沉淀的颜色:

(4)利用Fe3+的氧化性
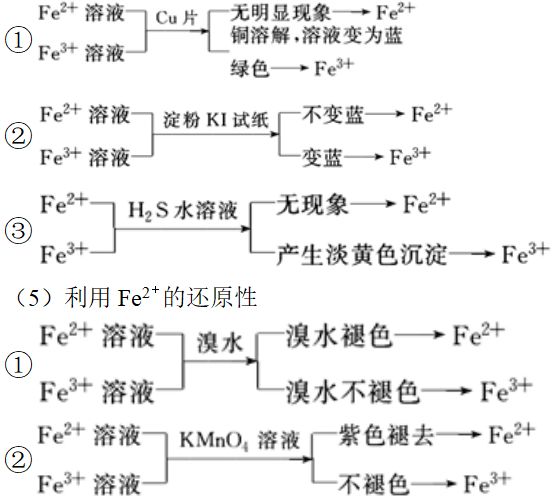
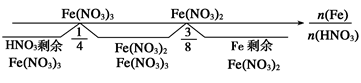
5、分析铁与稀HNO3反应的关键:
一是明确哪种物质过量,二是根据两种物质的量分析讨论判断,根据反应方程式:
HNO3过量:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
Fe过量时:Fe+2Fe(NO3)3=3Fe(NO3)2
两者相加得总方程式:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,可以用数轴表示:
6、离子守恒法在解有关离子反应计算题时的应用技巧:在离子反应中,元素的种类不变,同种元素对应离子反应前后的物质的量守恒;在复杂离子反应或多步离子反应中,运用离子守恒的思路,选取具有守恒特征的某一离子,找出其在始态和终态物质中的等量关系,即可迅速求解。
二、铜及其化合物
(1)物理性质:铜是紫红色金属,具有良好的导电性、导热性和延展性。
(2)化学性质:
①与非金属反应:
例如2Cu+O2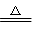 2CuO、2Cu+S
2CuO、2Cu+S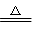 Cu2S、Cu+Cl2
Cu2S、Cu+Cl2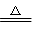 CuCl2。
CuCl2。
②氧化性酸的反应:例如Cu+2H2SO4(浓)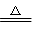 CuSO4+2H2O+SO2↑、Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑、3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑。
CuSO4+2H2O+SO2↑、Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑、3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑。
③与盐溶液的反应:2FeCl3+Cu=CuCl2+2FeCl2、Cu+2AgNO3=Cu(NO3)2+2Ag。
④在空气中生成铜绿:2Cu+CO2+O2+H2O=Cu2(OH)2CO3。